در فرآیند انجام مطالعات ژنتیکی، اغلب با نمونههای RNA ناکافی مواجه میشویم، مثلاً برای مطالعه تومورهای کوچک آناتومیکی دهان، حتی نمونههای تک سلولی، و نمونههایی از جهشهای ژنی خاص که در سطوح بسیار پایین در سلولهای انسانی رونویسی میشوند.البته برای تست کووید 19 اگر سواب ها در جای مناسب قرار نگیرند یا زمان های کافی در طول نمونه گیری نداشته باشند، حجم نمونه بسیار کم می شود، به همین دلیل کمیسیون سلامت و تنظیم خانواده دو روز پیش آمد و شد. تست را با موفقیت پشت سر گذاشت و اگر نمونهبردار اسید نوکلئیک شش نمونه نگرفت، میتوانید آن را گزارش کنید.
حساسیت معرف مهم است زیرا ما این مشکل یا آن مشکل را داریم، پس برای بهبود حساسیت RT-PCR چه کاری می توانیم انجام دهیم؟
قبل از اینکه راه حل های احتمالی را مورد بحث قرار دهیم، اجازه دهید به دو عارضه بزرگ با وضعیتی که اشاره کردیم اشاره کنیم.
اول از همه، ما نگران از دست دادن RNA هستیم که فقط چند جمعیت سلولی در نمونه خود داشته باشیم.در صورت استفاده از روشهای سنتی جداسازی و پاکسازی مانند روش ستونی یا روش بارش نوکلئیک اسید، احتمال از بین رفتن نمونههای کمی وجود دارد.یک راه حل اضافه کردن یک مولکول حامل مانند tRNA است، اما حتی در این صورت، هیچ تضمینی وجود ندارد که آزمایش بازیابی ما درست باشد.
پس راه بهتری چیست؟یک گزینه خوب برای سلول های کشت شده یا نمونه های میکروآناتومیک استفاده از لیز مستقیم است.
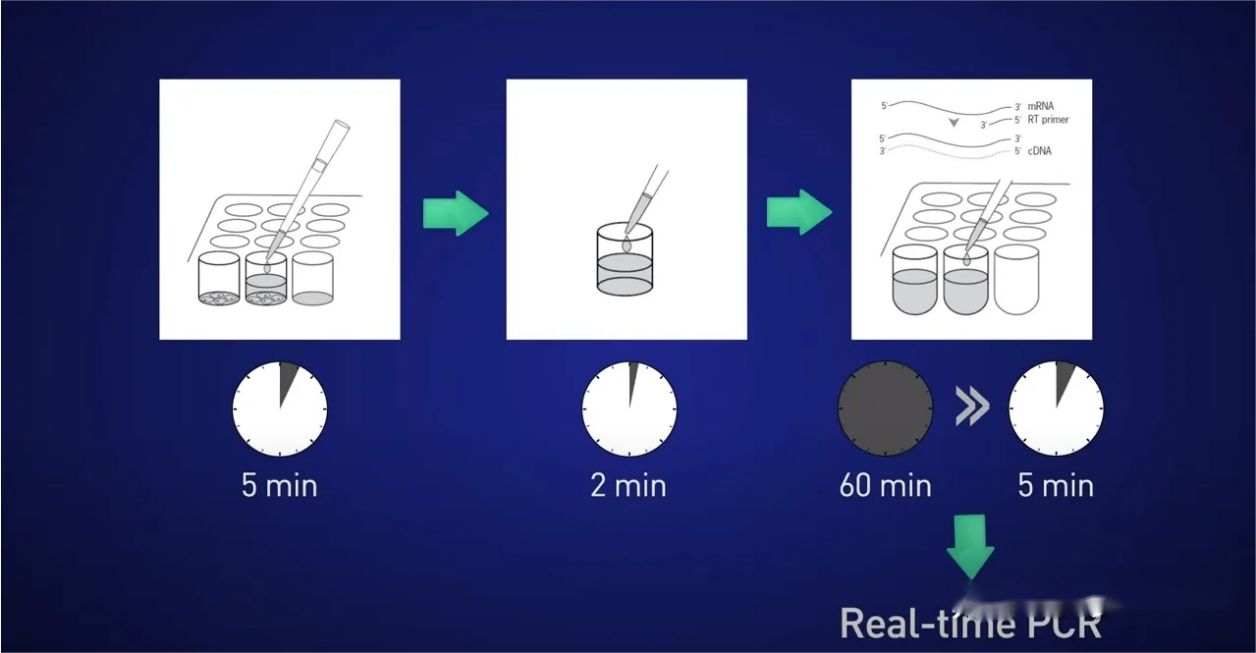
ایده این است که سلول ها را به مدت 5 دقیقه تقسیم کنیم، RNA را در محلول آزاد کنیم، سپس واکنش را به مدت 2 دقیقه متوقف کنیم، سپس لیز را مستقیماً به واکنش رونویسی معکوس اضافه کنیم تا هیچ RNAی از بین نرود و در نهایت cDNA حاصل را مستقیماً قرار دهیم. به واکنش بلادرنگ
اما اگر به دلیل یک نقطه شروع محدود یا مقدار کمی بیان ژن هدف، ما بتوانیم تمام RNA را بازیافت کنیم و همچنان الگوهای کافی برای دریافت سیگنال بلادرنگ خوب ارائه نکنیم، چه؟
در این صورت مرحله پیش تقویت می تواند بسیار مفید باشد.
در زیر طرحی برای افزایش حساسیت پس از رونویسی معکوس ارائه شده است.قبل از شروع، ما باید از پایین دست بپرسیم که به کدام اهداف علاقه مندیم، تا بتوانیم پرایمرهای خاصی را برای این اهداف برای پیش تقویت طراحی کنیم.
این را می توان با ایجاد یک آغازگر مخلوط با حداکثر 100 جفت پرایمر و چرخه واکنش 10 تا 14 بار به دست آورد.بنابراین، یک Master Mix به طور خاص برای این نیاز طراحی شده است تا cDNA به دست آمده از قبل تقویت شود.
دلیل تنظیم تعداد چرخه ها بین 10 تا 14 این است که این تعداد محدود چرخه تصادفی بودن بین اهداف مختلف را تضمین می کند که برای محققانی که به اطلاعات مولکولی کمی نیاز دارند بسیار مهم است.
پس از پیش تقویت، میتوانیم مقدار زیادی cDNA به دست آوریم، به طوری که حساسیت تشخیص در بکاند بسیار بهبود مییابد و حتی میتوانیم نمونه را رقیق کرده و چندین واکنش PCR را در زمان واقعی انجام دهیم تا خطاهای تصادفی احتمالی را حذف کنیم.
زمان ارسال: آوریل 11-2023